Sisältö
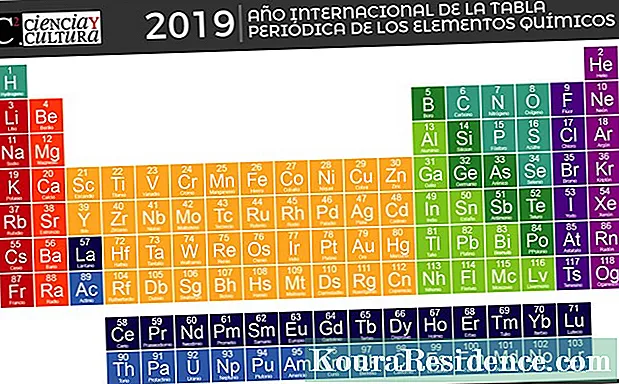
jaksollinen elementtitaulukko on kaavio (taulukko), johon kaikki ihmisen tuntemat kemialliset alkuaineet on järjestetty järjestyksessä niiden atomiluvun (protonien), elektronikonfiguraation ja spesifisten kemiallisten ominaisuuksien mukaan.
Se on perustavanlaatuinen käsitteellinen työkalu aineen tutkimiseen, jonka ensimmäinen versio julkaistiin vuonna 1869 venäläinen kemisti Dmitri Mendelejev ja jota on päivitetty vuosien varrella, kun uusia kemiallisia alkuaineita on löydetty ja niiden ominaisuuksien kuviot on ymmärretty paremmin.
Nykyinen jaksollinen taulukko on rakennettu seitsemään riviin (vaakasuora) jaksoja ja 18 (pystysuorassa) sarakkeessa kutsutaan ryhmille tai perheille. Kemialliset alkuaineet on järjestetty niiden ominaisuuksien mukaan vasemmalta oikealle ja ylhäältä alas, niiden atomien lukumäärän alenevassa järjestyksessä.
Katso myös: Esimerkkejä jaksollisen järjestelmän kemiallisista alkuaineista
Jaksollisen taulukon ryhmät
Numeroidut 1-18 vasemmalta oikealle, nykyiset ryhmien nimet määräytyvät nimikkeistön mukaan IUPAC hyväksytty vuonna 1988 olemassa olevien nimimuotojen yhtenäistämiseksi. Kunkin ryhmän elementeillä on samanlainen elektroninen kokoonpano ja sama valenssi (elektronit viimeisellä kiertoradalla), joten niillä on samanlaiset kemialliset ominaisuudet.
IUPAC: n mukaan on olemassa seuraavat elementtiryhmät:
- Ryhmä 1 (IA). Kaikki alkalimetallit, lukuun ottamatta vetyä, joka, vaikka se onkin nimellisesti ryhmässä, on kaasu. Elementit ovat osa perhettä: litium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs), frankium (Fr). Niillä on hyvin alhainen tiheys, ne ovat hyviä lämmön ja sähkön välittäjiä, eikä niitä koskaan löydy vapaasti luonnosta, vaan yhdisteistä muiden alkuaineiden kanssa.
- Ryhmä 2 (IIA). Niin sanotut maa-alkalimetallit ovat kovempia kuin emäksiset, kirkkaat ja hyvät sähköjohtimet, vaikkakin vähemmän reaktiivisia ja erittäin hyviä pelkistimiä (hapettimia). Perhe koostuu: beryllium (Be), magnesium (Mg), kalsium (Ca), strontium (Sr), barium (Ba) ja radium (Ra).
- Ryhmä 3 (IIIB). Ne muodostavat skandiumperheen, vaikka monissa taulukon segmentin “d” ryhmissä (ryhmät 3–12, mukaan lukien aktiinium ja harvinaiset maametallit) ei ole lopullista yksimielisyyttä ihanteellisesta järjestelystä. Tämä perhe koostuu skandiumista (Sc), yttriumista (Y), lantaanista tai lutetiumista (La) ja aktiniumista (Ac). Ne ovat kiinteitä, kiiltäviä ja erittäin reaktiivisia, ominaisuuksiltaan samanlaisia kuin alumiini.
Niin kutsutut "harvinaiset maametallit" tai sisäiset siirtymäelementit kuuluvat myös tähän ryhmään: lantanidit (tai lantanidit) ja aktinidit (tai aktinoidit), jotka löytyvät taulukon alaosasta. Lantanidit ovat: lantaani (La), cerium (Ce), praseodyymi (Pr), neodyymi (Nd), prometium (Pm), samarium (Sm), europium (Eu), gadolinium (Gd), terbium (Tb), dysprosium (Dy), Holmium (Ho), Erbium (Er), Thulium (Tm), Ytterbium (Yb), Lutetium (Lu). Aktiinidit ovat: torium (Th), proaktinium (Pa), uraani (U), neptunium (Np), plutonium (Pu), americium (Am), kurium (Cm), berkelium (Bk), kalifornium (Cf), einsteinium (Es), fermium (Fm), mendelevium (Md), nobelium (No) ja lawrencio (Lr). Neptuniumista lähtien ne ovat ihmisen luomia epävakaita isotooppeja.
- Ryhmä 4 (IVB). Niin kutsuttu titaaniperhe koostuu alkuaineista titaani (Ti), zirkonium (Zr), Hafnium (Hf) ja Rutherfordium (Rf), jälkimmäinen synteettinen ja radioaktiivinen, joten sitä ei joskus oteta huomioon. Ne ovat erittäin reaktiivisia metalleja, joten tietyissä esityksissä ne voivat välittömästi muuttua punaisiksi ja tulehtuneiksi joutuessaan kosketuksiin ilman hapen kanssa.
- Ryhmä 5 (VB). Vanadium (V) -perhe, jota johtaa loogisesti tämä elementti ja jota seuraa niobium (Nb), tantaali (Ta) ja dubnium (Db), jälkimmäistä tuotetaan yksinomaan laboratorioissa. Ne ovat kiinteitä huoneenlämmössä, hopeanvärisiä ja johtavat lämpöä ja sähköä.
- Ryhmä 6 (VIB). Kromi (Cr) -perhe, joka koostuu molybdeenistä (Mo), volframista (W) ja meriborgiumista (Sg), on kiinteä aine, jolla on korkea sulamis- ja kiehumispiste, lämmön ja sähkön johtimet, erittäin kestäviä korroosiota vastaan ja melko reagenssit.
- Ryhmä 7 (VIIB). Tästä perheestä löytyy mangaania (Mn), teknetiumia (Tc) ja reniumia (Re), samoin kuin alkuaine, jonka atominumero on 107, bohrium (Bh). Jälkimmäinen syntetisoitiin ensimmäisen kerran vuonna 1981, se on erittäin epävakaa, joten sen puoliintumisaika on vain 0,44 sekuntia. Yleensä linjat, renium ja teknetium ovat myös erittäin harvinaisia alkuaineita, joista jälkimmäisistä puuttuu vakaat muodot, kun taas mangaani on luonteeltaan hyvin yleistä.
- Ryhmä 8 (VIIIB). Rauta (Fe) -perheeseen kuuluvat rutiini (Ru), Osmium (Os) ja Hassium (Hs). Jälkimmäinen tunnettiin nimellä Unniloctio ja se syntetisoitiin ensimmäisen kerran vuonna 1984; se on lueteltu kiistanalaisissa kohdissa 104–108, joiden nimikkeistö on kyseenalaistettu. Ne ovat melko reaktiivisia elementtejä, hyviä lämmön ja sähkön johtimia ja raudan tapauksessa magneettisia.
- Ryhmä 9 (VIIIB). Tämä perhe on koboltti (Co), rodium (Rh), iridium (Ir) ja meitnerium (Mt). Kuten edellisessä ryhmässä, ensimmäinen on ferromagneettinen ja edustaa perheen ominaisuuksia, ja toinen on synteettinen, joten sitä ei ole luonnossa. Sen vakain isotooppi kestää itse asiassa noin 10 vuotta.
- Ryhmä 10 (VIIIB). Yhdessä ryhmien 8 ja 9 kanssa tämä perhe muodosti jaksollisen järjestelmän aiemmissa versioissa yhden ryhmän elementtejä. Viimeaikaiset versiot ovat erottaneet ne, ja tätä johtaa nikkeli (Ni), jonka mukana ovat palladium (Pd), platina (Pt) ja Darmstadtium (Ds). Ne ovat luonteeltaan yleisiä metalleja alkuainemuodossa, vaikka nikkeliä, joka on reaktiivisin, löytyy seoksesta (erityisesti joistakin meteoriiteista). Niiden katalyyttiset ominaisuudet tekevät näistä metalleista tärkeän toimituksen ilmailuteollisuudelle.
- Ryhmä 11 (IB). Niin kutsuttu kupari (Cu) -perhe koostuu jalometalleista kulta (Au) ja hopea (Pb). Ne tunnetaan myös nimellä "metallimetallit". Ne ovat melko reagoimattomia, vaikeasti syövyttäviä, pehmeitä ja erittäin hyödyllisiä ihmiselle.
- Ryhmä 12 (IIB). Tämä ryhmä sisältää niin kutsutun sinkki (Zn) -perheen, kuten kadmium (Cd), elohopea (Hg) ja kopernikium (Cn), joita aiemmin kutsuttiin ununbiumiksi. Ne ovat pehmeitä metalleja (itse asiassa elohopea on ainoa nestemäinen metalli huoneenlämmössä), diamagneettisia ja kaksiarvoisia, joiden sulamispisteet ovat kaikista siirtymämetalleista matalimmat. Hauska on, että sinkki on erittäin välttämätöntä elämän kemialle, kun taas kadmium ja elohopea ovat erittäin päihdyttäviä. Copernicium puolestaan on synteettinen elementti, joka luotiin vuonna 1996.
- Ryhmä 13 (IIIA). Nämä elementit tunnetaan maanläheisinä elementteinä, koska niitä on runsaasti maapallolla, erityisesti alumiinia. Ryhmää johtaa boori (Br), joka on metalloidi, ja sitten alumiini (Al), gallium (Ga), indium (In) ja tallium (Ta), jotka ovat yhä metallisempia laskeutuessaan kolonnissa. . Ja vaikka boorilla on korkea kovuus ja ei-metalliset ominaisuudet, muut ovat pehmeitä ja tempervalumaisia metalleja, joita ihminen käyttää laajalti.
- Ryhmä 14 (ALV). Hiilidioksidielementit, joiden johdossa ovat loogisesti hiili (C), pii (Si), germanium (Ge), tina (Sn) ja lyijy (Pb), kaikki tunnetut ja laajalle levinneet elementit, varsinkin ensimmäinen, välttämätön kaikelle kemialliselle aineelle. elämää. Kun siirrytään perhettä alaspäin, alkuaineet saavat metallisia ominaisuuksia siihen pisteeseen asti, että hiili on ei-metallista, pii ja germanium ovat puolimetallia ja kaksi viimeistä ovat selvästi metallisia.
- Ryhmä 15 (VA). Se on typpi-alkuaineiden ryhmä, jonka otsikkona on niiden nimi typen (N), sitten fosforin (P), arseenin (As), antimonin (Sb), vismuttin (Bi) ja muscovion (Mc), synteettinen elementti. Ne tunnetaan myös nimellä pannogeenit tai typenoidit, ne ovat erittäin reaktiivisia korkeissa lämpötiloissa, ja monet niistä ovat välttämättömiä orgaanisessa kemiassa.
- Lohko 16 (VIA). Kalkogeeneiksi tai amfigeeneiksi kutsutut ne kuuluvat happi- (O) -perheeseen, jota seuraa rikki (S), seleeni (Se), telluuri (Te) ja polonium (Po). Niille on tunnusomaista, että niissä on kuusi valenssielektronia, huolimatta niiden ominaisuudet vaihtelevat ei-metallisista metallisiin niiden atomiluvun kasvaessa. Huoneen lämpötilassa happi on kaasu, joka on erittäin reaktiivinen sen pienen koon vuoksi, kun taas loput ovat kiinteitä ja harvemmin luonteeltaan.
- Ryhmä 17 (VIIA). Halogeenien perhe, nimi, joka tulee sen taipumuksesta muodostaa suoloja (halogenideja). Tämä johtuu tosiasiasta, että ne muodostavat yleensä piimaa, jolla on huomattava hapetuskyky, mikä saa ne muodostamaan mononegatiivisia ioneja. Siksi niitä käytetään laajalti kemianteollisuudessa ja laboratoriotarvikkeiden valmistuksessa. Nämä alkuaineet ovat fluori (F), kloori (Cl), bromi (Br), jodi (I), astaaatti (At) ja tenese (Ts), jälkimmäinen on myös ryhmän f metalli.
- Ryhmä 18 (VIIIA). Jalokaasuina tai inertteinä kaasuina tunnettuja, ne ovat erittäin alhaisen reaktiivisuuden alkuaineita, joita esiintyy yleensä monatomisina kaasuina, hajuttomina, värittöminä, mauttomina, muodostaen hyvin harvinaisia ja poikkeuksellisia yhdisteitä niiden täydellisen elektronikuoren ansiosta. Nämä alkuaineet ovat helium (He), neon (Ne), argon (Ar), krypton (Kr), ksenoni (Xe), radoni (Rn) ja oganeson (Og). Nämä kaksi viimeistä ovat erityisiä: radoni on radioaktiivista eikä siinä ole stabiileja isotooppeja, joten se selviää vain 3,8 päivää; kun taas oganeson on synteettistä alkuperää ja tähän mennessä luotu raskain elementti.
Jaksolliset lohkot
Toinen tapa ymmärtää jaksollista taulukkoa on sen neljän lohkon kautta:
- Estä s. Se käsittää kaksi ensimmäistä ryhmää, toisin sanoen alkali- ja maa-alkalimetallit vedyn ja heliumin lisäksi.
- Estä s. Se sisältää kuusi viimeistä ryhmää, toisin sanoen jaksollisesta taulukosta 13-18, sekä kaikki metalloidit.
- Lohko d. Se sisältää ryhmät 3-12 ja kaikki siirtymämetallit.
- Lohko f. Sisältää harvinaiset maametallit: laktanidit ja aktinidit. Sillä ei ole omia ryhmänumeroita, vaikka oletetaan, että nämä elementit kuuluisivat 3: een.
- Lohko g. Hypoteettinen lohko, johon tulevaisuudessa syntetisoitavat elementit menisivät.


